最近發現在麻省理工大學媒體實驗室(MIT Media Lab)的課程How to grow(almost) everything又重啟了,剛好最近在學習做合成生物學領域的實驗,所以感覺是個不錯的學習路引,一慣地野蠻學習。
How to grow(almost) everything其實是另一門How to make almost everything(假如對How to make almost everything有興趣,可參考這篇介紹文章)的生物版本課程,由哈佛大學George Church、MIT的Jacobson以及David S. Kong所開設的。幾年前也有嘗試這個課程,但那時候的理解力還不夠,且自造能力等於零,如今大概比較成熟,有基礎的自造和實驗能力和背景知識。
第一週的課程,算是簡單的開場,以及討論實驗安全和倫理的問題,而George Church教授則是分享了整個領域目前在做的十個具有改變人們生活型態潛力的方向,話說,三年前閱讀完George Church的書Regenesis,便對其對當代影響真的頗為佩服。
便宜的DNA讀取和合成
合成生物學,簡單來說,其實是奠基在過往的分子生物學基礎上,更向前的去定義這個領域,相對於過去已探索生物體現象為主,改為利用生物體現象來創造如工程工具的技術,能將生物技術結合工程思維和快速迭代,主要歸功於我們對於基因定序(讀)和基因合成(寫)的技術進步,由下面Goerge Church的簡報可以看到,整個技術的進步,是比莫爾定律還誇張的。首先可以由下圖發現,定序基因也就是讀取生物內的資訊成本快速下降。
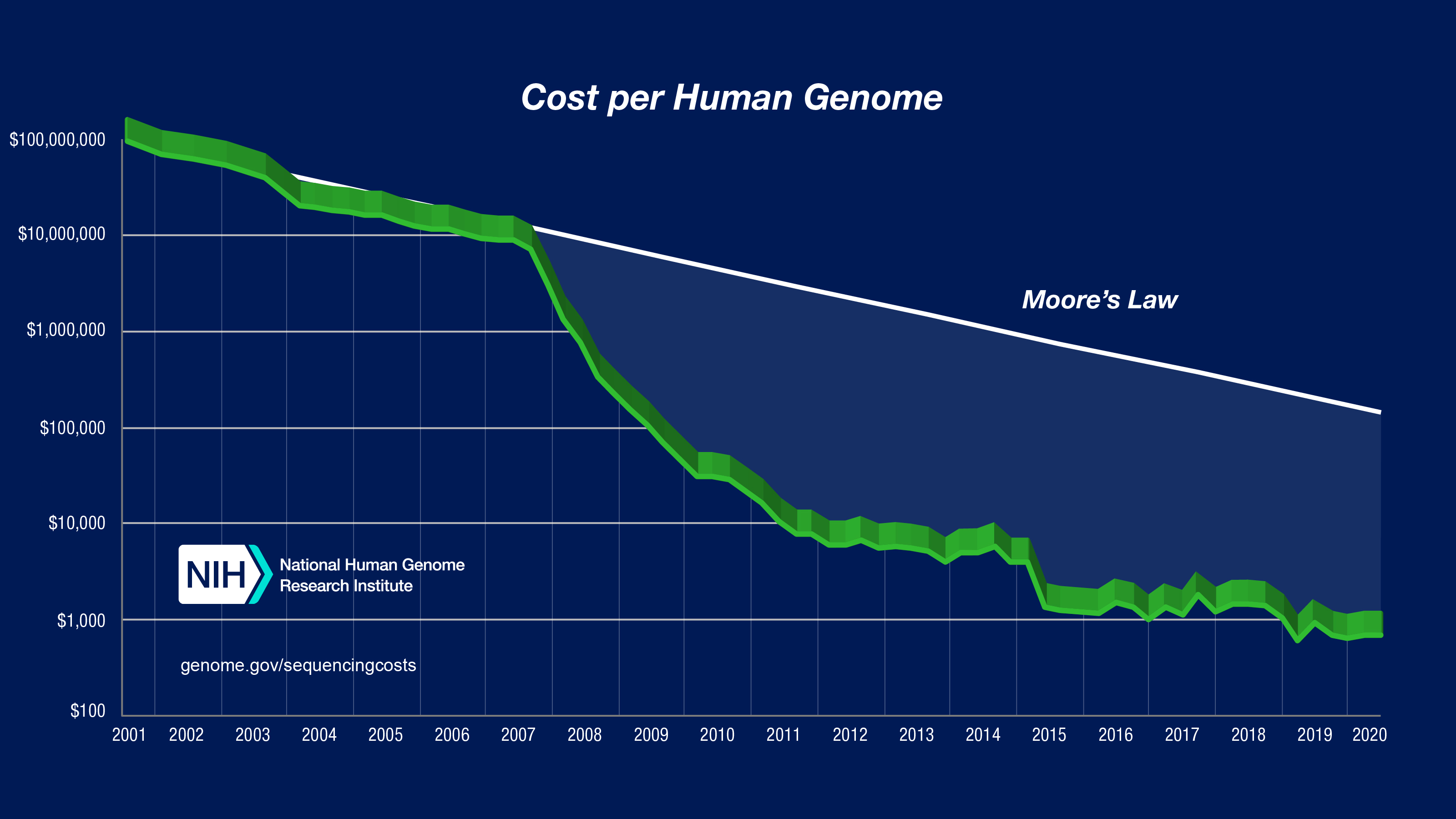
另一方面,基因合成的價格雖然沒有持續下降,但目前大約200bp以下,每個bp在美金0.07美元左右。這算是支持整個合成生物學向前的一個基本支持,而目前我們已有利用奈米孔洞蛋白的技術來改善合成和定序的方法,相信未來合成和定序整個基因組會更加的便宜和快速。
使用機器學習來做蛋白質設計
隨者定序和合成基因的成本降低,各種高通量的實驗設計變成為可能,隨之而來的巨量資料,便能利用來做近一步的預測,如今火紅的機器學習領域便可以用來設計蛋白質。下面兩個研究便是很好的典範轉移,將生物實驗從經驗性探索轉成資料導引的科研方式。
雖然在George Church的簡報裡面提到他實驗室的科學家Pierce J. Ogden和Eric D. Kelsic在2019年的發表,將機器學習應用於基因療法中,探討AAV病毒其外鞘蛋白序列要如何更有效率的去做突變和測試,這個方法學後來變成一間公司Dyno Therapeutics,導入於基因療法中。

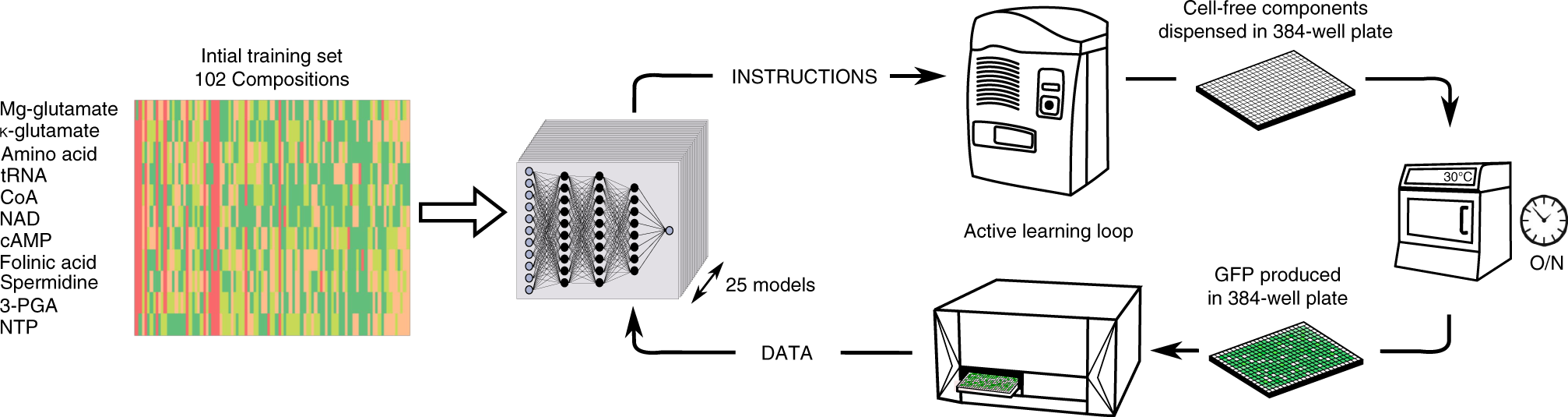
另外,我自己補充之前閱讀到的趨勢,在Carnegie Mellon University最近新成立的自動化科學Automation Science 的主任Robert F Murphy 也提到用機器學習的方法學搭配自動化高通量實驗技術。前陣子看到一篇文章也頗有趣的,利用一組數據102個可能的測試組合來做無細胞表達系統的最佳化。
使用DNA來當作儲存的工具
去氧核醣核酸,也就是DNA,本身以A、T、C、G四種組合,其實本質上,就是可以轉換成四進位的方式來儲存原本二進制的資料,比如影片、照片等等資訊,最早直接使用DNA來儲存“資料”的概念在1988年左右,由Joe Davis藝術家就有提到,但當時應該是處在“概念”階段,而在2012年左右George Church教授的實驗室也提出使用DNA作為資料儲存的方式,將一張照片轉換成四進制後儲存成ATCG的編碼,裡面也提及DNA作為儲存工具,其在資料密度及儲存穩定上是相當不錯的,這也歸功於定序和合成成本的下降,雖然目前合成的價錢相對來說較高。

也可以聽聽華大基因的podcast天方燁談:未來用什麼儲存資料 在2021年2月2號的這集,也簡單地談談用DNA做儲存的好處和近期發展,裡頭提到的哥倫比亞大學Harris Wang教授在這方面的努力,他本身研究生時就在George Chruch實驗室開發出MAGE方法學。
重新編碼基因:抵禦病毒感染
記得之前中國科學家賀建奎在2018年愛滋寶寶基因編輯事件中,其實就讓大家正視人類已經具有如此威力的技術,它實際上就是將人類的CCR5基因修改,這個基因是愛滋病毒進入人體的細胞表面受體,雖然這技術開啟很多可能,但也延伸許多未知的問題,比如這樣修改雖然能避免愛滋病感染,但會不會造成其他問題,畢竟CCR5是身體內本來就有功能的受體蛋白,另外,修改CCR5的過程多多少少有可能會不小心修改到其他基因,這些都是很多科學研究需要進一步探索的。
在2016年George Church團隊的一篇研究,目前生物體將三個RNA代碼對應相應的蛋白質生產或是相關指定,所以三碼代表自然界有4*4*4種可能,也就是64個相對應代碼,實際上,很多代碼是產生一樣的氨基酸的,基於這個思路,他們團隊思考重新編碼大腸桿菌,將64個氨基酸對應的代碼,縮減成57個,看是否會有因此對於大腸桿菌的一些正常生存能力造成影響。

這樣的實驗在以前是看起非常不可能的,大腸桿菌的基因組有4百60萬個鹼基,所以這樣大規模的編輯得力於如今許多技術的發展。近一步來說,這些方法學在醫學上可以發展細胞和基因療法,比如這五年來發展飛快的CART療法,將病人免疫T細胞收集出來後,進行基因工程,在注射回病人的療法,讓這些T細胞能便是這些癌症細胞。
重新調控皮膚細胞轉化成大腦細胞
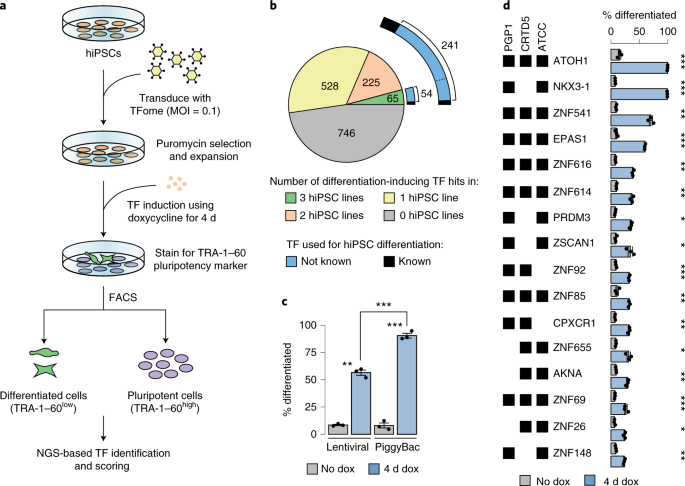
前面提到的大都以基因層面的編輯,但一個人體,同樣的基因體,有的細胞變成皮膚細胞,有的則變成大腦細胞,這些就是在調控層次的變化,雖然細胞調控牽涉到的機制非常複雜,但轉錄因子是其中具有重要角色的,藉由調控這些轉錄因子的表達,便能將細胞重新改變。在這篇2020年的研究中,科學家變利用漫病毒表現載體(Lentiviral expression vector)來調控誘發性幹細胞(hiPSCs),看其會造成分化上有何影響。
改造器官用於移植
器官移植在目前來說,技術已經臻於成熟,但苦於人類器官的來源非常短缺,從器官移植資料庫可以看出,能提供器官的捐贈者相對於需求者,兩者間有巨大的需求,那從跟人類基因體較相近的動物身上取得器官,可能是另一種解法,但其中有許多要克服的困難。

跨物種的移植(Xenotransplantation)要面對複雜的免疫排斥作用、栓塞和凝血功能之影響、組織相容性蛋白分型、豬內源性逆轉錄蛋白(Porcine endogenous retrovirus )等等,所以利用基因編輯技術來修改器官上面的受體,可以一步步慢慢解決這些困難,其中目前做得蠻好的是將豬內源性逆轉蛋白序列從豬器官中提除。
器官強化
抗老化及逆齡科學
老化是個非常複雜的過程,有非常多個理論在描述所謂老化的過程,目前認為由兩個機制來影響,一個是細胞內建的凋亡機制(Programming age)和細胞損傷造成,可以把他分成九個分子層面的因素:(1). 基因組不穩定 、(2). 端粒耗損(telomere attrition)、(3). 表觀調控改變、(4). 蛋白質代謝功能散失、(5). 代謝調控失衡、(6). 粒線體功能異常、(7). 細胞複製減緩(cellular senescence)、(8). 幹細胞耗盡(stem cell exhaustion)、(9). 細胞內通訊改變。

當可以把老化解構成不同分子層面的事件後,便能藉由調整生物分子路徑,來達成所謂的逆齡。在2019年,George Church的團隊發表一篇論文,使用腺病毒來做基因療法,針對三個基因: FGF21、TGFbetaR2、HFTC3,這三個基因已知跟許多人類慢性病相關,如糖尿病、關節炎和腎臟疾病,他們使用老鼠疾病模型來做驗證,觀察到在心臟衰竭的小鼠模型中,觀察到了58%的心臟功能提升,在αSMA表現量有38%降低以及腎臟髓質細胞萎縮下降約75%。目前也成立了一間公司Rejuvenatebio,先以寵物為標的在做發展。
資訊來源:
定序和合成基因的價錢變化
How to grow almost everything, week 1 material, MIT media lab
美國NIH定序人類基因組的價錢
https://www.genome.gov/about-genomics/fact-sheets/Sequencing-Human-Genome-cost
機器學習在蛋白質設計上的應用
Ogden, Pierce J., Eric D. Kelsic, Sam Sinai, and George M. Church. 2019. “Comprehensive AAV Capsid Fitness Landscape Reveals a Viral Gene and Enables Machine-Guided Design.” Science 366 (6469): 1139–43.
Borkowski, O., Koch, M., Zettor, A. et al. Large scale active-learning-guided exploration for in vitro protein production optimization. Nat Commun 11, 1872 (2020). https://doi.org/10.1038/s41467-020-15798-5
將DNA用在資料儲存
Church, George M., Yuan Gao, and Sriram Kosuri. 2012. “Next-Generation Digital Information Storage in DNA.” Science 337 (6102): 1628.
重新編碼基因
Ostrov, Nili, Matthieu Landon, Marc Guell, Gleb Kuznetsov, Jun Teramoto, Natalie Cervantes, Minerva Zhou, et al. 2016. “Design, Synthesis, and Testing toward a 57-Codon Genome.” Science 353 (6301): 819–22.
基因和細胞療法
Liu X, Zhang Y, Cheng C, et al. CRISPR-Cas9-mediated multiplex gene editing in CAR-T cells. Cell Res. 2017;27(1):154-157. doi:10.1038/cr.2016.142
Larson, R.C., Maus, M.V. Recent advances and discoveries in the mechanisms and functions of CAR T cells. Nat Rev Cancer (2021). https://doi.org/10.1038/s41568-020-00323-z
重新調控將皮膚細胞改造成大腦
Ng, A.H.M., Khoshakhlagh, P., Rojo Arias, J.E. et al. A comprehensive library of human transcription factors for cell fate engineering. Nat Biotechnol (2020). https://doi.org/10.1038/s41587-020-0742-6
改造移植用器官
Ways to reduce the kidney shortage, New York Times, 2014
Niu, Dong, Hong-Jiang Wei, Lin Lin, Haydy George, Tao Wang, I-Hsiu Lee, Hong-Ye Zhao, et al. 2017. “Inactivation of Porcine Endogenous Retrovirus in Pigs Using CRISPR-Cas9.” Science 357 (6357): 1303–7.
Yang, Luhan, Marc Güell, Dong Niu, Haydy George, Emal Lesha, Dennis Grishin, John Aach, et al. 2015. “Genome-Wide Inactivation of Porcine Endogenous Retroviruses (PERVs).” Science 350 (6264): 1101–4.
Sykes, Megan, and David H. Sachs. 2019. “Transplanting Organs from Pigs to Humans.” Science Immunology 4 (41). https://doi.org/10.1126/sciimmunol.aau6298.
Yang, Siyoung, Noriyuki Fujikado, Dmitriy Kolodin, Christophe Benoist, and Diane Mathis. 2015. “Immune Tolerance. Regulatory T Cells Generated Early in Life Play a Distinct Role in Maintaining Self-Tolerance.” Science 348 (6234): 589–94.
抗老化
Khosla, Sundeep, Joshua N. Farr, Tamara Tchkonia, and James L. Kirkland. 2020. “The Role of Cellular Senescence in Ageing and Endocrine Disease.” Nature Reviews. Endocrinology 16 (5): 263–75.
Kruempel, Joseph C. P., Marshall B. Howington, and Scott F. Leiser. 2019. “Computational Tools for Geroscience.” Translational Medicine of Aging 3 (November): 132–43.
Magalhães, João Pedro de, and Olivier Toussaint. 2004. “GenAge: A Genomic and Proteomic Network Map of Human Ageing.” FEBS Letters 571 (1-3): 243–47.
Melzer, David, Luke C. Pilling, and Luigi Ferrucci. 2020. “The Genetics of Human Ageing.” Nature Reviews. Genetics 21 (2): 88–101.
Partridge, Linda, Matias Fuentealba, and Brian K. Kennedy. 2020. “The Quest to Slow Ageing through Drug Discovery.” Nature Reviews. Drug Discovery 19 (8): 513–32.
Rebelo-Marques, Alexandre, Adriana De Sousa Lages, Renato Andrade, Carlos Fontes Ribeiro, Anabela Mota-Pinto, Francisco Carrilho, and João Espregueira-Mendes. 2018. “Aging Hallmarks: The Benefits of Physical Exercise.” Frontiers in Endocrinology 9 (May): 258.
Rijt, Sanne van der, Marte Molenaars, Rebecca L. McIntyre, Georges E. Janssens, and Riekelt H. Houtkooper. 2020. “Integrating the Hallmarks of Aging Throughout the Tree of Life: A Focus on Mitochondrial Dysfunction.” Frontiers in Cell and Developmental Biology 8 (November): 594416.
Tacutu, Robi, Daniel Thornton, Emily Johnson, Arie Budovsky, Diogo Barardo, Thomas Craig, Eugene Diana, et al. 2018. “Human Ageing Genomic Resources: New and Updated Databases.” Nucleic Acids Research 46 (D1): D1083–90.